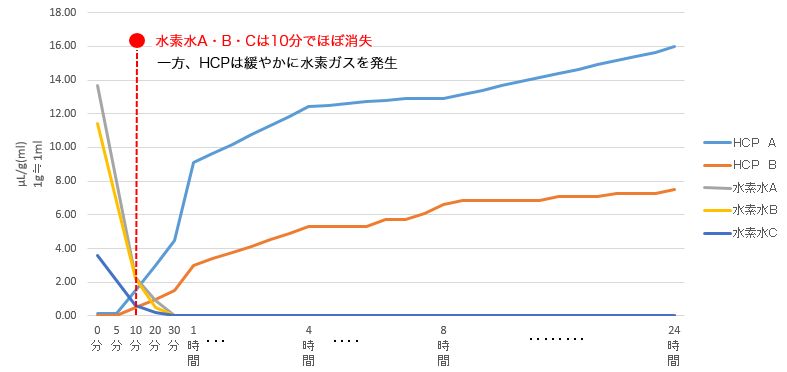
同様のサンゴ系他社水素吸着素材に比べ、「圧倒的に多くの水素ガスを発生」します。
その発生量は、ガス発生量が設計値どおり一定であるという厳格な条件を充足していることを証明するため、製造ロット毎に世界標準である「ガスクロマトグラフィー」で正確に分析しております。
液体は封を開けてから発生する水素ガス(水素分子)量を、固体(粉末)は固体が液体に触れてから発生する水素ガス(水素分子)量を測定しています。近年、技術開発が進歩し、製造時に沢山の水素を保持できるようになってきましたが、水素ガス(水素分子)発生量と共に、水素ガス(水素分子)が発生する時間や推移等から鑑みて、ユーザー様の摂取環境に適した選択がのぞまれます。
上のグラフによると、水素水は封を開けてから20分で水素ガス(水素分子)発生量がほぼ0になることから、10分位で飲み干す用途に適しています。一方、粉末の吸着素材に水素を吸着させた当社の製品は、液体に触れてからじわじわと長時間水素ガス(水素分子)が発生するので、ゆっくり飲むもしくは、粉末をそのまま体内に摂取するのが好ましいといえます。
それでは、他社の水素吸着素材との比較をしてみましょう。
同様他社粉末系 水素素材との比較
| 同様他社粉末系 水素素材との比較 | ||||
|---|---|---|---|---|
| 商品名 | HCP A (平均粒度約67μ) |
HCP B (平均粒度約2.5μ) |
S社 水素素材 |
T社 水素素材 |
| 主成分 | カルシウム (天然水由来) (主成分 : 炭酸カルシウム) |
カルシウム (天然水由来) (主成分 : 炭酸カルシウム) |
ゼオライト サンゴカルシウム 蠣殻 |
サンゴ カルシウム |
| 水素ガス発生量 | ~20μL/g | 5~8μL/g | ~0.01μL/g | ~0.2μL/g |
| 水素発生 持続時間 |
48時間 | 48時間 | 48時間 | 48時間 |
| 主な効用 | 抗酸化 代謝UP |
抗酸化 代謝UP |
抗酸化 デトックス |
抗酸化 デトックス |
※ガスクロマトグラフィーによる水素ガス定量分析値(同様の測定条件により、第三者機関にて分析。
この表からもわかります通り、他社の水素吸着素材と比較しても、格段に水素ガス(水素分子)発生量が多いことがわかります。
水素は、拡散性の高いものですので、肝心な体内環境において、発生・吸収を示唆できるかが重要です。当社の水素吸着素材(HCP)は、疑似的胃液と腸液に素材が触れてから水素ガス(水素分子)が発生することを確認しています(下記検査結果参照)。
つまり、通常状態では水素は安定的に保持され、「体内環境でより多くの水素ガス(水素分子)を持続的に発生させることができる素材」です。
【検査内容】
当社の究極の水素吸着素材の擬似的な胃、腸環境下における水素の定量及びpHの確認。
【試料】
原料をそのまま操作に用いた。なお、pHの確認においては、参考としてHCP A配合の最終製品Aをカプセルのまま試料に加えた。
【試料及び機器】
塩酸-塩化カリウム緩衝液(pH=1.2) リン酸緩衝液(pH=6.8) 純水
ガスクロマトグラフ : 島津GC-14AT データ処理装置 : 島津クロマトパック C-R7A
pHメーター (Horiba F-55)
【水素ガス(水素分子)定量分析における試料処理】
擬似胃液環境 :
3gの粉末試料を33mLの容器に取り、塩酸-塩化カリウム緩衝液(pH=1.2)15mLを加えて室温に静置後、GCへの注入前に容器を激しく振って容器下部に沈殿した粉末を分散させたのち気相0.5mLをGCに注入した。容器の空間容積は18mLである。
塩酸-塩化カリウム緩衝液(pH1.2)の調整方法 :
100mL容メスフラスコに1.49gの塩化カリウム(分子量 : 74.5)を分取し、脱イオン水でメスアップした(0.2mol/L塩化カリウム水溶液)。次に50mL容メスフラスコに5.07gの36%塩酸(分子量 : 36.5)を分取し、脱イオン水でメスアップした(1.0mol/L塩酸)。さらに5倍希釈して0.2mol/L塩酸を調整した。200mL容メスフラスコに0.2mol/L塩化カリウム水溶液50mL、0.2mol/L塩酸64.5mLをそれぞれ分取し、脱イオン水でメスアップした。これを塩酸-塩化カリウム緩衝液(pH1.2)とした。
擬似腸液環境 :
3gの粉末試料を33mLの容器に取り、リン酸緩衝液(pH=6.8)15mLを加えて室温に静置後、GCへの注入前に容器を激しく振って容器下部に沈殿した粉末を分散させたのち気相0.5mLをGCに注入した。容器の空間容積は18mLである。
リン酸緩衝液(pH6.8)の調整方法 :
100mL容メスフラスコに2.40gのリン酸二水素ナトリウム(無水 分子量 : 120.0)を分取し、脱イオン水でメスアップした(0.2mol/Lリン酸二水素ナトリウム水溶液)。次に100mL容メスフラスコに2.84gのリン酸水素二ナトリウム(無水 分子量 : 142.0)を分取し、脱イオン水でメスアップした(0.2mol/Lリン酸水素二ナトリウム水溶液)。200mL容メスフラスコに0.2mol/Lリン酸二水素ナトリウム水溶液51mL、0.2mol/Lリン酸水素二ナトリウム49mLをそれぞれ分取し、脱イオン水でメスアップした。これをリン酸緩衝液(pH6.8)とした。
【水素ガス(水素分子)定量分析方法】
100ppm相当のH2標準ガスを調整し、0.5mLを注入して検量を行った。
分析指定時間については、10分、20分、40分、1時間、4時間、8時間、24時間の7測定を行った。表①は基礎的なデータで容器中気相部のH2濃度(ppm)を示している。
各操作段階における画分の状態は、以下に示す通りであった。
【表① 水素定量分析結果】
| 時間(h) | 0.17 | 0.33 | 0.67 | 1 | 4 | 8 | 24 |
|---|---|---|---|---|---|---|---|
| HCP A (擬似胃環境) |
1268 | 2054 | 2599 | 2803 | 3305 | 3569 | 3714 |
| HCP A (擬似腸環境) |
765 | 1454 | 2138 | 2317 | 2537 | 2606 | 2674 |
| HCP B 微粉砕品(擬似胃環境) * |
146 | 248 | 356 | 439 | 672 | 769 | 841 |
| HCP B 微粉砕品(擬似腸環境) * |
38 | 61 | 95 | 115 | 191 | 232 | 350 |
H2濃度(ppm)
*微粉砕原料の特徴として、水素ガス(水素分子)の発生がゆっくり(水素保持力が高い)ゆえ、24h経過以降の測定においても数値の上昇が予測される。
この種の分析で、H2発生量をppmで表示すると容器の容積、採取試料重量によって異なる数値となり、客観性を欠く為、試料1gからの発生量をμLまたはμgで表すのが一般的である。濃度単位(ppm)から、試料1g当たりのH2発生量への換算は以下のように行った。
例)試料「HCP A(擬似胃環境)」の10分経過後のデータ
①容積33mLの容器に塩酸-塩化カリウム緩衝液(pH1.2)15mLを加えたため、空間容積は18mL、容器への試料採取重量は3.0g、濃度は1268ppmである。
18mL中のH2の容量(μL)は、
(1268/10^6)*(18*100)≒22.82μL
②試料採取量は3.0gであるので、1g当たりのH2発生量は
22.82/3.0≒7.6μLとなる。
このように、容器容積、容器中のH2濃度から試料1g当たりのH2発生量(μL)に換算した結果を表②にまとめた。グラフ①は、経過時間とH2発生量(μL/g)をプロットしたもの。
【表② 水素定量分析結果 1gから発生するH2量】
| 時間(h) | 0.17 | 0.33 | 0.67 | 1 | 4 | 8 | 24 |
|---|---|---|---|---|---|---|---|
| HCP A (擬似胃環境) |
7.6 | 12.3 | 15.6 | 16.8 | 19.8 | 21.4 | 22.3 |
| HCP A (擬似腸環境) |
4.6 | 8.7 | 12.8 | 13.9 | 15.2 | 15.6 | 16.0 |
| HCP B 微粉砕品(擬似胃環境)* |
0.9 | 1.5 | 2.1 | 2.6 | 4.0 | 4.6 | 5.0 |
| HCP B 微粉砕品(擬似腸環境) * |
0.2 | 0.4 | 0.6 | 0.7 | 1.1 | 1.4 | 2.1 |
単位 : μL/g
*微粉砕原料の特徴として、水素ガス(水素分子)の発生がゆっくり(水素保持力が高い)ゆえ、24h経過以降の測定において数値の上昇が予測される。
【グラフ① H2発生量(μL/g)と経過時間の関係】
単位 : μL/g
【pH分析における試料処理】
擬似的な胃・腸環境についての試料処理及び緩衝液調整は、上記の水素定量分析におけるものと完全に一致させた。尚、指標として純水による環境でのpHの確認も測定している。
【pH分析方法】
Horiba F-55 pH meterを使用して、数値が安定したところをpH値とし(各3回測定)、表③に示した。
【表③ pH測定結果】
初期緩衝液 pH HCl/KCl(擬似的胃環境) 1.257 PBS(擬似的腸環境) 6.821
| 測定結果 | HCl/KCl | PBS | 純水 | |||
|---|---|---|---|---|---|---|
| 採取量(g) | pH | 採取量(g) | pH | 採取量(g) | pH | |
| HCP A | 2.9997 | 6.24 | 3.0273 | 7.04 | 2.9922 | 9.66 |
| 3.0186 | 6.25 | 2.9888 | 7.02 | 2.9925 | 9.74 | |
| 3.0079 | 6.24 | 3.0349 | 6.99 | 3.0248 | 9.77 | |
| 平均 | 6.24 | 7.02 | 9.72 | |||
| 測定結果 | HCl/KCl | PBS | 純水 | |||
|---|---|---|---|---|---|---|
| 採取量(g) | pH | 採取量(g) | pH | 採取量(g) | pH | |
| HCP B (微粉砕品) |
3.0242 | 6.26 | 3.0083 | 7.89 | 3.0176 | 9.83 |
| 3.0223 | 6.31 | 3.0056 | 7.87 | 2.9804 | 10.02 | |
| 3.0039 | 6.27 | 2.9898 | 7.93 | 3.0321 | 10.04 | |
| 平均 | 6.28 | 7.90 | 9.96 | |||
| 参考測定結果 | HCl/KCl | PBS | 純水 | |||
|---|---|---|---|---|---|---|
| 採取量(g) | pH | 採取量(g) | pH | 採取量(g) | pH | |
| 他社商品E/水素α* | 4 tablets | 6.1 | 4 tablets | 7.2 | 4 tablets | 7.51 |
| 4 tablets | 6.1 | 4 tablets | 7.2 | 4 tablets | 7.56 | |
| 4 tablets | 6.1 | 4 tablets | 7.2 | 4 tablets | 7.48 | |
| 平均 | 6.15 | 7.20 | 7.52 | |||
*:1cap当たりの内容量570mg(宮古島産Ca …375mg、バレイショデンプン…177.5mg、ショ糖エステル…15mg、二酸化ケイ素…2.5mg)
【結論】
原料の水溶液は、純水環境において中性から弱アルカリを呈している。これは熱処理によってカルシウム(天然水由来)が、ごく微量酸化カルシウムとして存在し、溶解することによって示されたもので、原料由来のものであると考えられる。
CaO + H2O → Ca(OH)2 ⇒塩基性を示す
原料は純水環境で弱アルカリを示していたものが、擬似的な胃環境(強酸性)及び腸環境(中性)に向かうと、中性寄りの数値が導き出されている。この推移は原料の主成分(炭酸カルシウム)から想定できる中和的反応の結果であると考える。
ちなみに、HCP AとHCP B(微粉砕原料)ではpHにわずかに差があり、微粉砕原料がアルカリ側に傾いている。上記で述べた酸化カルシウムの影響も考えられ、溶解性が良いものと思われる。
*参考① : 食物の流れ(pH)
口腔(pH=7)
↓
食道(pH=7)
↓
胃(食前pH=1~2 : 殺菌、食中pH=3~4 : 消化、食後pH=1~2 : 殺菌)
↓
十二指腸(pH=6~7)
↓
小腸(pH=5~6)
↓
大腸(pH=5~7)
*参考② : 食物の流れ(時間)
口腔~食道(固体物30秒~60秒)
↓
胃(滞在時間 : 約4時間、胃液で一部を消化吸収)
↓
小腸(十二指腸・空腸・回腸、滞在時間 : 7~9時間、栄養分・水分を消化吸収)
↓
大腸(結腸・直腸、滞在時間 : 25~30時間、食物のカスや腸内細菌などが混ざり便となる)
実際には、カプセルや錠剤等の性質によって、どこで原料が水分に触れ、水素ガス(水素分子)の発生及び吸収がなされるのか厳密には計れないが、
一つの指標として上記の環境(参考①・②)と照らし合わせ、生体内での水素ガス(水素分子)の発生と吸収を示唆することは可能であると考える。
水素は優れた抗酸化物質として期待されていますが、拡散性は高く不安定なのが課題。
この課題を克服すべく考えられた特許製法により「安定的な水素保持を実現」しました。
特殊製法でつくられたこの素材は、通常環境でそのまま放置しても、賞味期限の間、水素が保たれていることをガスクロマトグラフィーという分析方法で確認しています。
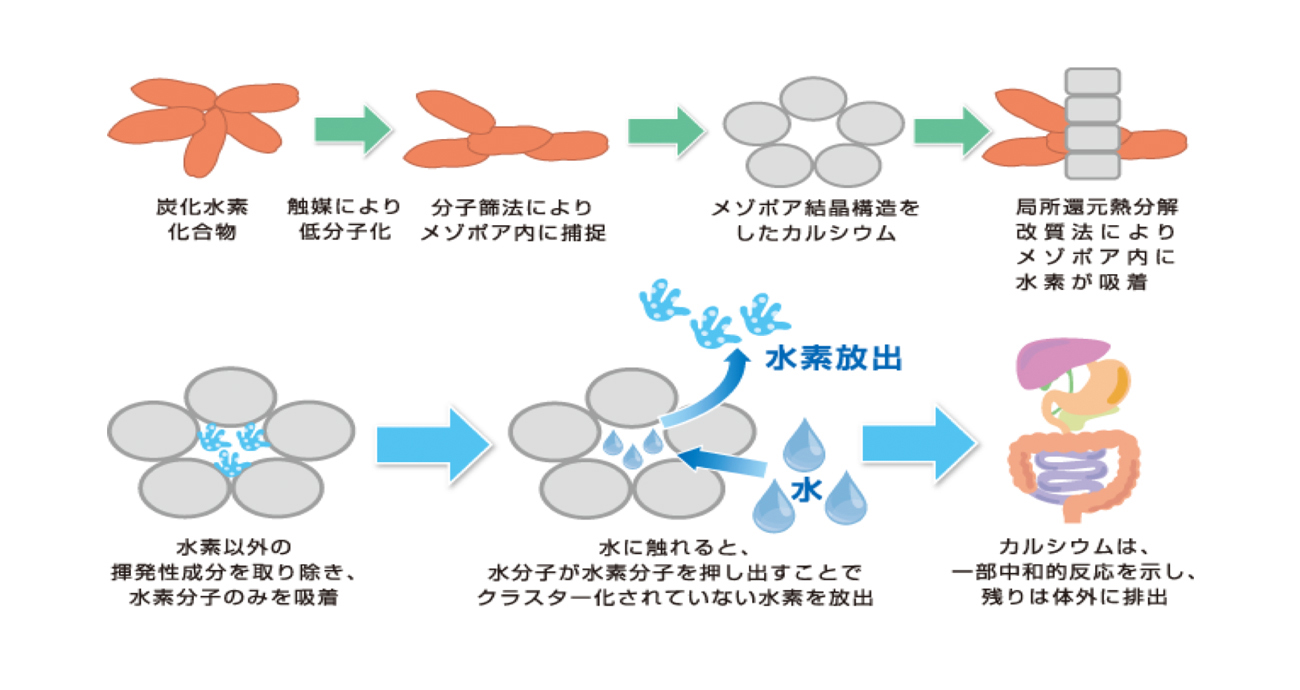
・水素吸着のメカニズム
触媒により低分子化された炭化水素化合物は分子篩法によりカルシウムのメゾポア結晶構造に取り込まれ、局所還元熱分解により水素分子とその他の物質に分解されます。
水素分子はラングミュアー吸着等温式に従いメゾポア結晶構造のカルシウムに吸着されていると考えられ、クラスター化されていない水素分子が分子1個ずつの形態でメゾポア内に吸着します。
特許第4472022号「水素含有炭酸カルシウム及びその製造方法」
1.水素含有炭酸カルシウムの生成工程
炭酸カルシウムを含む水溶液中にアルカリ剤を加え
pHを8~9程度に上昇させることにより不溶性の
炭酸カルシウムが析出し、乾燥・粉砕する。
2.宮古島カルシウム(主成分 : 炭酸カルシウム)のメゾポア生成工程
生成された炭酸カルシウムを低温(200~500℃)焼成する
ことにより水分、その他の揮発性成分を一定条件下で脱気して
炭酸カルシウム内にメゾポアを形成する。
3.分子篩法による溶媒補足工程
炭酸カルシウムのメゾポア内に分子篩法により炭化水素系溶液に浸漬し、溶媒分子を補足する。
4.局所還元熱分解改質工程
炭酸カルシウムのメゾポア内に補足された溶媒分子を局所的還元熱分解(250~400℃)により低分子改質を行う。
5.メゾポア内への水素吸着
水素以外の揮発成分を加熱除去して水素のみ吸着する。
当社の水素吸着素材(HCP)は、乾燥に近い低温(400℃以下)で加工するので、結晶構造・主成分・ミネラル等、素材の組成が変わらず維持されたまま水素保持され、かつ「副生成物発生の可能性は低く安全性が高い」ことが特徴です。
小ロットで、製造条件を厳密に管理し、丁寧に製造しているため、毎回同じ品質が保たれており、製造ロットごとの品質のバラつきはありません。
製造ロット毎にガスクロマトグラフィーで分析し、水素ガス(水素分子)発生量を確認しています。
水素素材としてよく使用される通常のサンゴカルシウムは、ワシントン条約に抵触しないよう(生きたサンゴの摂取がないよう)、国内では砂利採取法に基づき、許可されたエリアの海底から採取されます。
一方、宮古島カルシウムですが、サンゴ礁でできた島・宮古島の地下に滞留した天然水(超硬水)から、Ca成分を抽出して生まれたものになります。つまり、同じサンゴ系のCaでも生成方法が異なります。
自然の恵みを活かし、宮古島の行政によって、島民の生活水を確保する際に均一で良質なCaも生成されるのです。
*宮古島周辺は、沖縄本島周辺とも異なる世界で一番若い琉球石灰岩層に属しています。
若いサンゴゆえ、溶けやすく、そのままでは天然地下水は超硬水で飲めません。行政(水道局)によって水からCa成分を抽出し、軟水化され、生活水とCaに分けられます。
そうして生まれた宮古島Caは、独特の多孔質性を有しています。宮古島カルシウムの主成分は、炭酸カルシウムです。自然の恵みを活かし、宮古島の行政によって、島民の生活水を確保する際に生成された、均一で良質な宮古島カルシウムを独占的に使用し、Only one の水素関連商品をオーダーメイド致します。